Noticias
Modificaciones de seguridad de la DIGEMID:
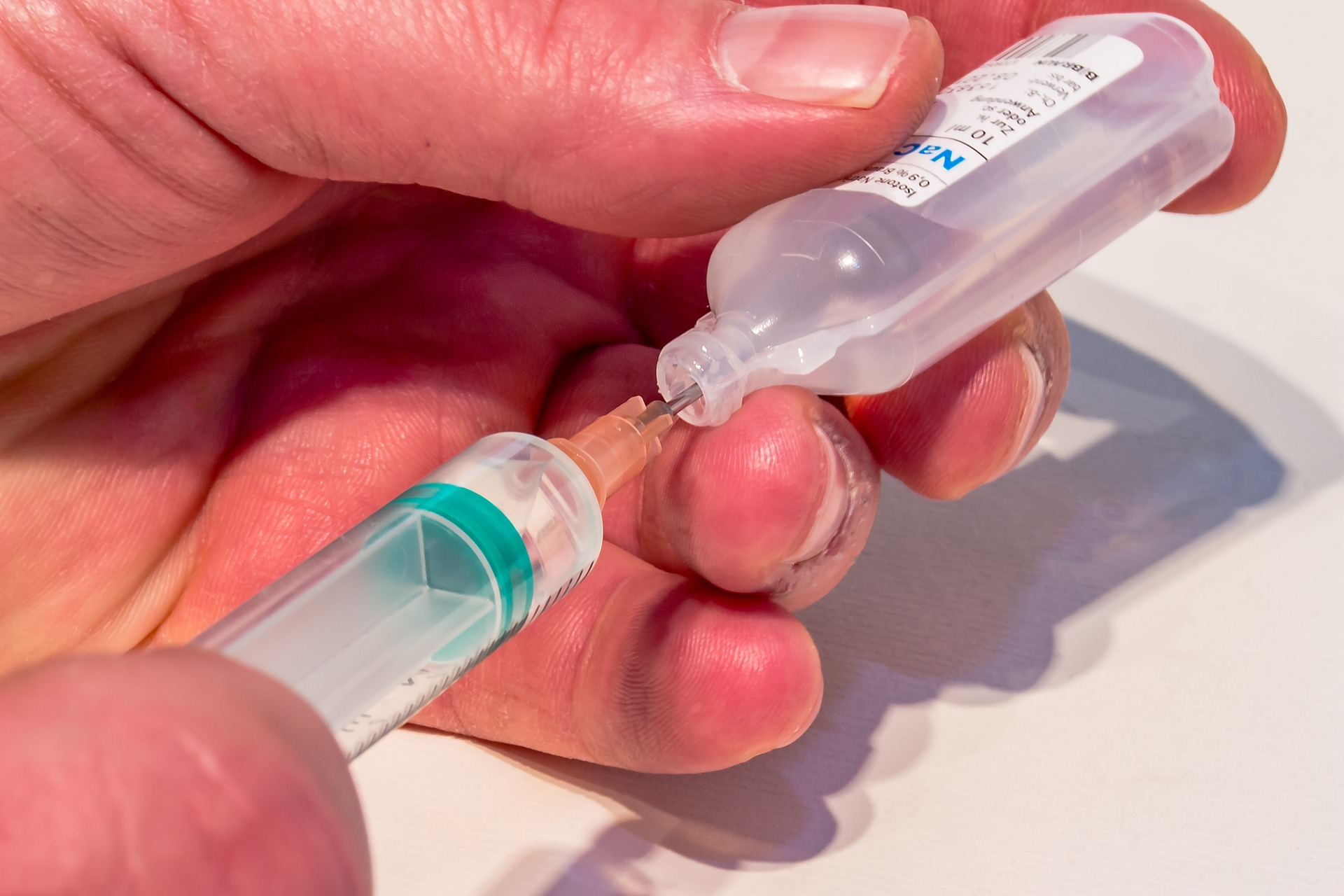
Para los productos farmacéuticos que contienen “BACILLUS CLAUSII”

La DIGEMID a través de la R.D. Nº 5545-2020-DIGEMID/DPF/MINSA publicada el 05 de agosto de 2020, dispuso lo siguiente:
- Los titulares de los registros sanitarios de los productos farmacéuticos que contengan Bacillus clausii, bajo la forma farmacéutica de suspensión oral y con forma de presentación frascos o ampollas bebibles menores o iguales a 5mL, deberán incluir en el rotulado mediato e inmediato la advertencia: “SOLO PARA USO ORAL” y un pictograma que signifique “No inyectar”.
- Los procedimientos de inscripción de los registros sanitarios de los productos farmacéuticos que contengan Bacillus clausii, también deben cumplir con lo dispuesto en el citado documento.
Fuente: DIGEMID
Publicaciones recientes

El MINSA dispone publicar proyecto de resolución ministerial que resuelve incluir en el PNUME para el sector salud, el producto oxígeno medicinal 93% gas

Modificaciones de seguridad de la DIGEMID Para las especialidades farmacéuticas que contienen “MELOXICAM”

Modificaciones de seguridad de la DIGEMID: Para los productos farmacéuticos que contienen “BACILLUS CLAUSII”

Modificaciones de seguridad de la DIGEMID: Para las especialidades farmacéuticas que contienen “MONTELUKAST”

Modificaciones de seguridad de la DIGEMID: Para las especialidades farmacéuticas que contienen “LORCASERINA”

Modificaciones de seguridad de la DIGEMID: Para las especialidades farmacéuticas que contienen “FENOTEROL”

El MINSA aprobó la “Norma técnica de salud que establece los criterios éticos para la promoción y publicidad de productos farmacéuticos, dispositivos médicos y productos sanitarios”

Aprueban directiva sanitaria para el control y vigilancia de los dispositivos de diagnóstico in vitro: Pruebas rápidas y moleculares para covid-19

El MINSA incorporó la ficha denominada: IVERMECTINA solución oral 6 mg/ml en la norma técnica de salud para la elaboración de preparados farmacéuticos

El MINSA incorporó productos farmacéuticos al listado de bienes esenciales para el manejo y tratamiento del covid-19

El MINSA publicó proyecto de reglamento que regula los cambios en el registro sanitario de los dispositivos médicos

Directiva administrativa que establece el procedimiento para el suministro de datos al observatorio peruano de productos farmacéuticos de los bienes esenciales para el manejo del COVID-19

Comunicado de DIGEMID referente a la atención virtual de comunicaciones de la información de droguerías, laboratorios y almacenes especializados

Comunicado de DIGEMID referente a la autorización excepcional

Aprueban el “Listado de productos Galénicos”

Disposiciones para la inscripción, reinscripción y cambios en el registro sanitario y la importación, de productos farmacéuticos y dispositivos médicos; y para el funcionamiento de los establecimientos farmacéuticos

Prórroga de la suspensión del cómputo de plazos de tramitación de los procedimientos administrativos

Modifican la directiva sanitaria para el control y vigilancia de los dispositivos de diagnóstico in vitro: pruebas rápidas y moleculares para COVID-19

Modifican la norma técnica de salud para la elaboración de preparados farmacéuticos